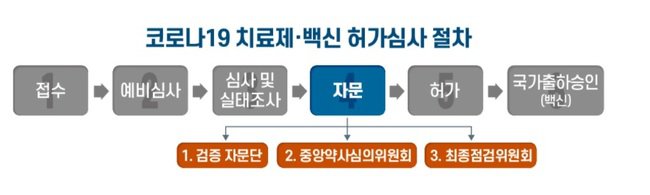
식품의약품안전처(이하 식약처)는 코로나19 치료제·백신 허가심사의 객관성과 투명성 확보를 위한 외부 전문가 자문 계획을 발표했다.
식약처는 코로나19 대유행의 엄중한 상황을 감안해, ‘코로나19 치료제/백신 안전성·효과성 검증 자문단’(이하 검증자문단)과 ‘최종점검위원회’를 추가로 구성해 3중의 자문 절차를 거치도록 했다.
‘검증 자문단’은 중앙약사심의위원회 자문에 앞서 다양한 전문가들로부터 임상·비임상·품질 등 분야에 대한 자문 의견을 식약처가 수렴하는 절차로서 감염내과 중심의 임상 전문가, 비임상·품질·임상통계 등의 전문가 30명 내외로 전문가 인력풀을 사전에 구성했으며, 안건에 따라 해당 분야 전문가들이 참석한 자문단 회의를 개최한다.
‘중앙약사심의위원회’는 '약사법' 제18조에 따른 식약처 자문기구로서, 신청 품목의 안전성, 효과성, 허가 시 고려해야 할 사항 등을 자문한다. 자문위원은 생물의약품분과위원회의 상임위원과 관련 전문가 등 15명 내외로 구성되며 검증 자문단에서 논의한 사항, 임상적 유용성 등에 대해 자문한다.
식약처는 최종 허가 결정에 앞서 내·외부 전문가(10명 내외)가 공동으로 참여하는 ‘최종점검위원회’를 개최, 검증 자문단과 중앙약사심의위원회 자문결과를 토대로 최종 점검을 실시한다고 밝혔다.
한편, 식약처는 셀트리온 ‘렉키로나주’의 임상시험자료에 대한 ‘검증 자문단’ 회의를 1월 17일 실시하고, 그 결과를 1월 18일 공개한다. 검증 자문단 회의에서는 ‘렉키로나주’ 임상시험에서 활용된 임상적 효과측정 지표와 약물의 작동 원리 측정 지표에 대한 임상 결과가 이 약의 치료 효과를 인정하기에 적절한지 등에 대해 자문받을 계획이다.
식약처는 코로나19 치료제·백신의 허가심사 과정에 있어 다양한 전문가 의견을 수렴해 객관성과 투명성을 확보하는 한편, 철저한 허가·심사가 이뤄질 수 있도록 노력하겠다고 전했다.








댓글을 작성하려면 로그인 해주세요.